Introducción
El virus de la inmunodeficiencia humana (VIH) continúa siendo un problema de salud pública mundial, a pesar de la introducción de la terapia antirretroviral (TARV) y el manejo profiláctico de las infecciones oportunistas más prevalentes. En muchos de los casos, el compromiso pulmonar es la primera manifestación de la infección por VIH (1) y se asocia con múltiples etiologías. Pese a la multiplicidad de condiciones pulmonares documentadas en individuos con VIH, el diagnóstico no siempre corresponde a un agente aislado, puesto que la coexistencia de diferentes enfermedades, sean infecciosas o no, ocurre hasta en el 20 % de los casos (2).
Dado que la epidemiología de las infecciones de las vías respiratorias en pacientes con VIH ha cambiado en las últimas décadas, es fundamental conocer con precisión los datos locales, puesto se comportan de forma diferente a los de la población global. De hecho, una gran parte de los individuos con la enfermedad consultan en estadios avanzados y no todos presentan adherencia óptima a la TARV, a pesar de que la cobertura en Colombia se acerca al 100 %, según información de la Organización Mundial de la Salud (1).
Epidemiología
Se estima que cerca de 36,9 millones de individuos alrededor del mundo vivían con VIH a finales de 2014, de los cuales solo el 40 % recibía TARV (3,4). En Colombia, para el año 2013, la prevalencia de VIH/sida fue del 0,45 %, con una incidencia significativa en el grupo de edad de 15 a 49 años. La mortalidad acumulada como consecuencia del sida en Colombia, entre 1991 y 2012, alcanzó 39.886 defunciones (1,3,4).
La incidencia de las infecciones pulmonares en pacientes con VIH ha cambiado en las últimas décadas, debido a la introducción de la TARV, en 1996, y a la profilaxis para Pneumocystis jirovecii y otras infecciones oportunistas. En la actualidad, puede considerarse una enfermedad crónica con una tendencia creciente a la aparición de comorbilidades no infecciosas (5), lo que responde principalmente a un incremento en la esperanza de vida de esta población (6). Respecto a la epidemiología local, se han reportado cuatro estudios colombianos que documentan los principales agentes etiológicos del compromiso pulmonar y su presentación clínica en diferentes instituciones del país (tabla 1).
Tabla 1
Características de los estudios colombianos que han reportado compromiso pulmonar
en el paciente con VIH/sida
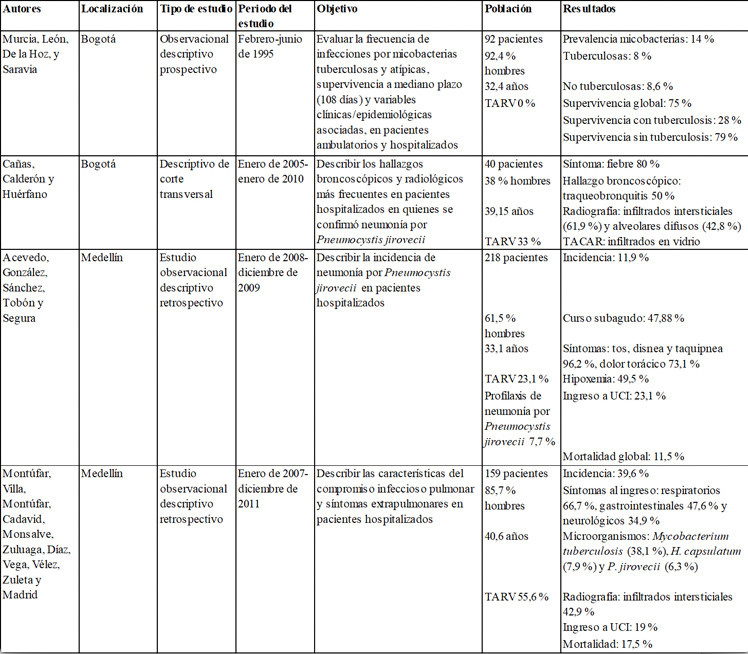
Murcia y cols (7) realizaron un estudio en Bogotá en 1995 en el que hicieron hincapié en las infecciones respiratorias por micobacterias, con una prevalencia de 14 %. Encontraron que los pacientes infectados por Mycobacterium tuberculosis tuvieron una supervivencia mucho menor que aquellos infectados por otro tipo de micobacterias (28 % vs. 79 %, respectivamente).
En otro estudio descriptivo realizado por Cañas y cols (8), en Bogotá, entre 2005 y 2010, se reportó como síntoma principal de la infección por Pneumocystis jirovecii la fiebre (80 %); adicionalmente, se describió como hallazgo más frecuente en la radiografía de tórax los infiltrados intersticiales (61,9 %), seguido por los infiltrados alveolares difusos (42,8 %). Entre tanto, en la tomografía axial computarizada de alta resolución (TACAR) el principal hallazgo obtenido fue la presencia de patrón en vidrio esmerilado en el 92,3 % de los pacientes.
Por otro lado, Acevedo y cols (9), en un hospital en Medellín, entre 2007 y 2011, encontraron que el 23,1 % de los pacientes infectados por Pneumocystis jirovecii ingresaba a la unidad de cuidados intensivos (UCI) con una mortalidad global del 11,5 %.
En el estudio más reciente, en pacientes hospitalizados en Medellín, Montúfar y cols (2) describieron como agente infeccioso más prevalente al Mycobacterium tuberculosis (38,1 %), seguido por Histoplasma capsulatum (7,9 %) y P. jirovecii (6,3 %). Adicionalmente, reportaron como manifestación clínica más frecuente los síntomas respiratorios (66,7 %), seguidos por los gastrointestinales (47,6 %) y los neurológicos (34,9 %).
Enfermedades infecciosas
Neumonía adquirida en la comunidad
La neumonía adquirida en la comunidad (NAC) representa una causa importante de morbilidad en este grupo poblacional y se ha estimado que de los pacientes con VIH hospitalizados, del 5 % al 20 % padecen neumonía bacteriana (10). Se considera una enfermedad definitoria del sida cursar con dos episodios de NAC en un lapso de un año (11).
Únicamente en el 35 % de los casos se obtiene un diagnóstico etiológico (11,12,13). El microrganismo aislado más frecuentemente es Streptococcus pneumoniae, al igual que en la población general, y está implicado en aproximadamente el 20 % de los casos de coinfección NAC/VIH, seguido por la infección por bacterias gramnegativas. Del 10 % al 15 % de los casos de NAC corresponden a la infección por Haemophylus influenzae y también se ha reportado un incremento en la frecuencia de infección por Pseudomonas aeruginosa y Staphylococcus aureus, este último asociado al uso de drogas intravenosas (11,14). P. aeruginosa y S. aureus se identifican típicamente en pacientes con conteo de CD4+ menor a 50 células/mm3.
La infección por Legionella pneumophila sigue siendo infrecuente en los pacientes con VIH/sida; pero es hasta 40 veces más frecuente que en la población general y se ha descrito como un factor de mal pronóstico. Otros agentes etiológicos menos prevalentes son Rhodococcus equi y Nocardia asteroides. El primero afecta a pacientes con inmunosupresión avanzada y suele tener un curso indolente. El segundo tiene una incidencia 140 veces mayor en esta población con respecto a la población general, especialmente en pacientes con conteo de CD4+ menor a 100 células/mm3 (14).
Se ha encontrado que la infección por VIH puede aumentar hasta 10 veces el riesgo de presentar NAC (14). Otros factores de riesgo que favorecen su aparición incluyen bajo estrato socioeconómico, tabaquismo, uso de drogas intravenosas, comorbilidades médicas y conteo de CD4+ menor de 200 células/mm3 (11,14,15). Los sujetos con inmunosupresión avanzada pueden presentar clínica atípica consistente en fiebre de bajo grado, tos seca, alteración del estado de conciencia y pérdida de peso (11).
Entre los estudios complementarios que pueden emplearse para evaluar la gravedad de la infección se encuentran los descritos en la Escala de Severidad para NAC, la CURB 65 (16); además de la oximetría de pulso, hemograma y gases arteriales. Los pacientes con VIH precisan la realización de hemocultivos y prueba de esputo con la intención de aislar el agente causal, debido a la frecuencia de bacteriemia asociada. La radiografía de tórax confirma el diagnóstico clínico y la imagen puede ser similar a la de un paciente inmunocompetente, con evidencia de consolidación y broncograma aéreo. También se pueden hallar infiltrados intersticiales difusos, derrame pleural y cavitaciones. Debido a la alta frecuencia de coinfección con otros microrganismos, que alcanza hasta el 20 % en pacientes con NAC/VIH, la broncoscopia con lavado broncoalveolar (LBA) puede ser necesaria según la sospecha clínica y el grado de inmunosupresión del paciente (10).
El principal factor pronóstico es el conteo de CD4+. Los pacientes con coinfección NAC/VIH con conteos inferiores a 200 células/mm3 deben hospitalizarse; mientras que los pacientes con conteos mayores a 200 células/mm3 se pueden manejar según el Índice de Severidad de Neumonía (11). La tasa de mortalidad en coinfección NAC/VIH varía entre las diferentes series publicadas; sin embargo, la mayoría reporta cifras entre el 10 % y el 15 % (15). Se considera que la mortalidad y el tiempo de estancia hospitalaria son similares a las de pacientes con NAC sin infección por VIH (17).
El tratamiento es muy similar al empleado en pacientes seronegativos. La terapia empírica debe instaurarse lo antes posible teniendo en cuenta los perfiles de resistencia locales. En general, los pacientes con indicación de manejo ambulatorio pueden recibir un betalactámico en combinación con un macrólido (11). Dado que la NAC es una causa importante de morbimortalidad en pacientes con VIH, es vital fortalecer los programas de inmunización y cesación tabáquica para disminuir el riesgo de infección (14).
Neumonía por Pneumocystis jirovecii
La neumonía por Pneumocystis jirovecii fue la primera infección oportunista documentada en la población con VIH (18) y se considera que existe una probabilidad del 75 % de presentarla en algún momento del curso de la enfermedad (14). P. jirovecii se clasifica como un hongo y se caracteriza por su facilidad para colonizar las vías respiratorias y causar enfermedad únicamente en sujetos inmunosuprimidos. Se presenta en pacientes con conteo de CD4+ menor a 200 células/mm3 y habitualmente con carga viral mayor a 10.000 copias (19).
Constituye una infección subaguda de curso progresivo, con un periodo inicial de hasta un mes de evolución de tos seca y disnea (20). La mayoría de los pacientes con VIH presenta falla respiratoria de manera progresiva y manifiesta síntomas pulmonares inespecíficos (21). El examen físico puede no sugerir un proceso infeccioso; sin embargo, algunos pacientes tienen compromiso respiratoria importante con taquipnea, cianosis y, como consecuencia, hipoxemia con incremento del gradiente alvéolo arterial (14,22).
Los principales hallazgos radiológicos descritos son infiltrados intersticiales, nódulos, neumatoceles, cambios quísticos y neumotórax (23). En la tomografía axial computarizada se puede observar patrón en vidrio esmerilado con distribución en parches o con opacidades difusas bilaterales (figura 1) (20). El patrón de oro es la demostración directa del microrganismo, bien sea en esputo, lavado broncoalveolar (LBA) o biopsia pulmonar. El LBA establece el diagnóstico en el 90 % de los casos y el porcentaje de neutrófilos en la muestra se considera un predictor de mortalidad a 90 días (8). Otros métodos diagnósticos incluyen anticuerpos monoclonales para P. jirovecii y reacción en cadena de la polimerasa; sin embargo, el rendimiento de estas pruebas no supera el de los métodos convencionales (20).
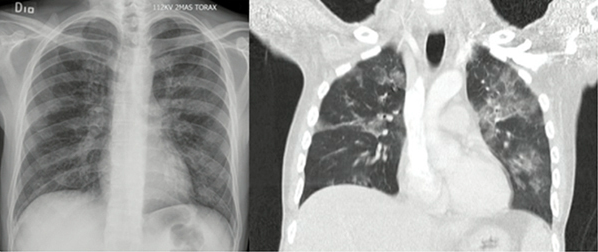 Figura 1
Compromiso pulmonar por Pneumocystis
jirovecii
Figura 1
Compromiso pulmonar por Pneumocystis
jirovecii
Es importante anotar que la gravedad de la neumonía por Pneumocystis jirovecii no depende de los hallazgos radiológicos ni del conteo de leucocitos, sino de otros factores que incluyen la edad del individuo, el uso de profilaxis para P. jirovecii, la saturación de oxígeno durante la hospitalización, las concentraciones de deshidrogenasa láctica, los niveles de hemoglobina, la albúmina sérica, el conteo de neutrófilos en el LBA, la presencia o ausencia de neumotórax, las comorbilidades médicas y el requerimiento de ventilación mecánica (24).
La primera línea de tratamiento en sujetos con enfermedad moderada a severa, según el gradiente alvéolo arterial de oxígeno es trimetoprima/sulfametoxazol. Se recomienda una duración del tratamiento de tres semanas y las dosis usuales son 15 a 20 mg/kg de trimetoprima y 75 a 100 mg/kg de sulfametoxazol. Antes de iniciarlo, es necesario prever posibles efectos adversos, incluyendo hepatotoxicidad, nefrotoxicidad, aplasia medular y erupción cutánea (22). Los corticoesteroides están indicados cuando se documenta una presión parcial arterial de oxígeno menor de 60 mm Hg o un gradiente alvéolo arterial mayor de 35 mm Hg (25). La profilaxis para neumonía por Pneumocystis jirovecii debe instaurarse en pacientes con conteos de CD4+ menores a 200 células/mm3 (25).
Tuberculosis
En el mundo se estima que de las personas que viven con VIH, al menos, 14 millones presentan infección por Mycobacterium tuberculosis (26). La infección por VIH aumenta 20 veces el riesgo de desarrollar tuberculosis en comparación con pacientes seronegativos que viven en zonas endémicas. De hecho, la presencia del retrovirus favorece la reactivación de enfermedad latente y la progresión a enfermedad diseminada en casos de infección activa (27). Adicionalmente, es la causa de muerte de una de cada tres personas con sida en el mundo (25), por lo que es importante descartar esta patología en los pacientes sintomáticos respiratorios con diagnóstico de infección por VIH.
La tuberculosis puede desarrollarse en cualquier momento del curso de la enfermedad; no obstante, las manifestaciones clínicas varían según el grado de inmunosupresión. En los pacientes con conteo de CD4+ entre 350 y 400 células/mm3, los síntomas son similares a los de pacientes seronegativos; mientras que las personas con conteos iguales o menores a 200 células/mm3, usualmente, presentan un patrón de tuberculosis primaria, en el que las cavitaciones son menos frecuentes y la radiografía de tórax puede ser normal. Los pacientes en estadios avanzados presentan tuberculosis extrapulmonar diseminada (28).
Una de las formas de presentación de la tuberculosis extrapulmonar es la afectación de la glándula suprarrenal. La tuberculosis adrenal corresponde a la segunda etiología más frecuente de masas adrenales bilaterales, con una prevalencia del 27,1 %, después del feocromocitoma, que corresponde al 40 % de los casos (29). La importancia de sospechar y reconocer de manera oportuna esta condición radica en que cerca del 100 % de los casos cursa con insuficiencia adrenal primaria por destrucción de la corteza de la glándula, que puede poner en riesgo la vida (30). Los síntomas más significativos incluyen hipotensión, anorexia, pérdida de peso, vómito e hiperpigmentación cutánea (31). El diagnóstico precisa la realización de tomografía computarizada o resonancia magnética, que usualmente documentan granulomas tuberculosos, necrosis caseificante, cicatrices y calcificaciones. Una vez instaurada la insuficiencia adrenal, la quimioterapia antituberculosa es insuficiente para reestablecer la función normal de la glándula (31).
Entre los síntomas asociados a enfermedad por M. tuberculosis, los reportados con mayor frecuencia incluyen tos, fiebre, pérdida de peso, diaforesis y expectoración (27,32). El diagnóstico se realiza de la misma forma en que en las personas sin VIH. Frente a la sospecha de enfermedad latente, en pacientes asintomáticos sin historia de tuberculosis, la valoración inicial requiere una prueba cutánea de derivado proteico purificado, que se considera positiva con un resultado igual o mayor a 5 mm de induración; sin embargo, los individuos con inmunosupresión avanzada pueden presentar resultados falsos negativos (1). En los casos de enfermedad activa, el diagnóstico precisa un estudio microbiológico basado en las baciloscopias y el cultivo, y el diagnóstico definitivo necesita el aislamiento de M. tuberculosis.
El cultivo de esputo es mucho más sensible que la baciloscopia, y en las personas con VIH debe ser un examen de rutina, ya que incrementa la sensibilidad del diagnóstico, sobre todo en pacientes con enfermedad avanzada que suelen ser paucibacilares. En estos casos, es útil emplear métodos moleculares como GeneXpert (Xpert MTB/RIF®), una reacción en cadena de la polimerasa en tiempo real que detecta la presencia de M. tuberculosis multirresistente en esputo y la resistencia a rifampicina. Fernández y cols (33) efectuaron un estudio de corte transversal con 468 pacientes sintomáticos respiratorios con sospecha de tuberculosis, cuyo objetivo era determinar las características operativas de esta prueba según el estado de inmunosupresión. En individuos con VIH y baciloscopias negativas, GeneXpert (Xpert MTB/RIF®) tuvo una sensibilidad, especificidad, valor predictivo positivo y valor predictivo negativo de 89 %, 99 %, 89 % y 99 %, respectivamente. Por lo tanto, los resultados de dicho estudio apoyan la realización de una prueba GeneXpert (Xpert MTB/RIF®) a todos los pacientes con sospecha de tuberculosis/VIH, dado que constituyen un grupo de alto riesgo para M. tuberculosis multirresistente (33,34,35).
Al igual que en otras infecciones, la radiografía de tórax es útil en la evaluación inicial, para determinar patrones radiográficos que usualmente se correlacionan con hallazgos clínicos específicos; pero existen situaciones en las que la radiografía es normal a pesar de la alta sospecha de afectación pulmonar, por lo cual estaría indicada la realización de una TACAR. Se estima que los sujetos con neumonía por Pneumocystis jirovecii y tuberculosis pueden presentar radiografías normales en cerca del 39 % y el 14 % de los casos, respectivamente (36). De este modo, se considera pertinente complementar el estudio con TACAR cuando la sospecha clínica es elevada; por lo general, en pacientes con estados avanzados de inmunosupresión, en quienes la radiografía simple no es tan sensible como para corroborar el diagnóstico (36).
La tuberculosis pulmonar en pacientes con VIH no presenta ningún signo radiológico patognomónico. En casos de inmunosupresión leve, los hallazgos son similares a los de pacientes inmunocompetentes, con presencia de cavitaciones e infiltrados apicales; mientras que en casos de inmunosupresión severa los hallazgos habitualmente son atípicos, con predominio de afectación ganglionar y signos de diseminación hematógena, como infiltrados intersticiales difusos y patrón miliar (figura 2) (25). En esta población, el tratamiento es muy similar a personas inmunocompetentes; sin embargo, el compromiso extrapulmonar puede requerir extensión de la segunda fase de la terapia hasta doce meses (25).
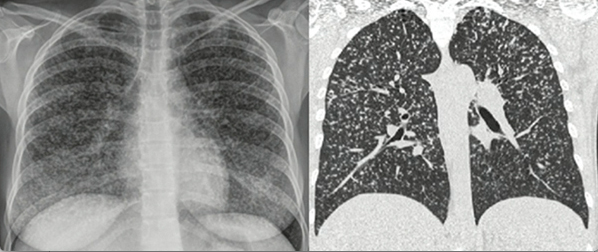 Figura 2
Afectación
pulmonar por tuberculosis
Figura 2
Afectación
pulmonar por tuberculosis
Micobacterias
atípicas
El Mycobacterium avium complex corresponde al grupo de
micobacterias no tuberculosas más prevalente en pacientes con infección por VIH.
Suele presentarse en sujetos con recuentos de CD4+ inferiores
a 50 células/mm3 y también se ha descrito en el síndrome inflamatorio
de reconstitución inmune (37). Por lo general, es
causa de enfermedad diseminada y el principal hallazgo radiológico son las bronquiectasias
multifocales asociadas a enfermedad de la vía aérea pequeña, aunque las imágenes
pueden ser normales en 25 % de los sujetos (14,37).
Infecciones por hongos
Las infecciones por hongos son causa importante de morbilidad en pacientes con VIH. Los microrganismos más prevalentes pueden variar según la región geográfica, pero las principales micosis incluyen criptococosis, histoplasmosis y otras micosis endémicas (38).
La criptococosis diseminada es una de las infecciones oportunistas definitorias de sida. Se calcula que alrededor de un millón de pacientes con infección por VIH desarrollan la enfermedad cada año (39). Es secundaria a la inhalación de levaduras de Cryptococcus y los principales serotipos patógenos incluyen las variedades C. neoformans grubii, C. neoformans neoformans y C. gatti (14). Se observa con mayor frecuencia en individuos con recuentos de CD4+ inferiores a 100 células/mm3 y el compromiso pulmonar constituye un cuadro subagudo con síntomas inespecíficos. Los principales hallazgos radiológicos incluyen nódulos con cavitaciones o sin estas, consolidación, infiltrados intersticiales bilaterales y derrame pleural. El diagnóstico microbiológico se basa en la detección de levaduras encapsuladas en el examen de tinta china o la identificación directa de C. neoformans en esputo o LBA con buen rendimiento (40).
La histoplasmosis es una de las micosis endémicas más importantes en pacientes con VIH. La incidencia de la enfermedad diseminada alcanza el 5 % en pacientes sin profilaxis antifúngica (41) y también es considerada una condición definitoria de sida. Entre las regiones con mayor prevalencia se encuentran el Caribe y América Latina, y el principal patógeno involucrado es Histoplasma capsulatum variedad capsulatum. La infección pulmonar se caracteriza por un síndrome constitucional acompañado de tos y disnea (38). El hallazgo más frecuente en la radiografía de tórax es un patrón miliar; sin embargo, puede haber afectación intersticial, opacidades reticulonodulares, macronódulos, cavernas, derrame pleural y adenopatías hiliares. El cultivo del LBA puede ser positivo en presencia de síntomas respiratorios, incluso con una radiografía normal; pero el resultado definitivo puede tardar hasta seis semanas (42,43,44).
Se ha descrito afectación asintomática de la glándula suprarrenal en pacientes con histoplasmosis diseminada (45). A pesar de ser la infección fúngica más asociada con insuficiencia suprarrenal primaria, es una etiología infrecuente (46); sin embargo, al igual que en la tuberculosis adrenal, es fundamental identificar las manifestaciones de hipofunción de la glándula, dado que es una condición potencialmente fatal. En este caso, la sintomatología suele resolver posterior al manejo antifúngico (45).
Otras micosis endémicas prevalentes incluyen las enfermedades producidas por Blastomyces dermatitidis, Coccidioides immitis, Paracoccidioides braziliensis y Penicillium marneffei. En la mayoría de los casos se diagnostican en el contexto de un síndrome constitucional asociado a síntomas respiratorios en pacientes con recuentos de CD4+ bajos, naturales de regiones geográficas específicas o con antecedentes de viajes recientes (38).
Infecciones por virus
La prevalencia del citomegalovirus, también conocido como virus herpes humano tipo 5, varía entre el 45 % y el 100 %, dependiendo de la región geográfica (47) y se documenta en pacientes con recuentos de CD4+ inferiores a 50 células/mm3. El curso de la enfermedad se caracteriza por una infección latente con primoinfección a temprana edad y reactivación posiblemente secundaria al fracaso de la TARV (38).
La presentación típica es la retinitis y, con menor frecuencia, cuadros pulmonares que pueden atribuirse a coinfección con otros patógenos oportunistas como P. jirovecii (14). Los hallazgos radiológicos sugestivos de infección viral incluyen infiltrados intersticiales y patrón en vidrio esmerilado en la tomografía axial computarizada. El hallazgo de citomegalovirus en el LBA suele ser indicador de pronóstico pobre (38). Los pacientes con VIH también pueden cursar con cuadros virales asociados a otros agentes etiológicos frecuentes en individuos inmunocompetentes, como influenza y parainfluenza, motivo por el cual se considera necesaria la vacunación anual (14).
Infecciones por parásitos
El principal
agente causal es Toxoplasma gondii. Generalmente, corresponde a una infección
latente, cuya reactivación se asocia con la disminución del recuento de CD4+.
La neumonía por toxoplasma se manifiesta de manera similar a la neumonía por P.
jirovecii (14,38). En la radiografía de tórax pueden observarse
infiltrados intersticiales bilaterales difusos, nódulos, cavitaciones y derrame
pleural. El diagnóstico definitivo requiere la detección directa del microrganismo
en muestra del LBA o realización de pruebas inmunológicas.
Enfermedades no infecciosas
Neoplasias definitorias de
sida: sarcoma de Kaposi y linfoma no Hodgkin
El sarcoma
de Kaposi es una neoplasia de origen endotelial asociada a la infección por virus
herpes humano tipo 8. En la actualidad, es más frecuente encontrarlo en individuos
con recuentos de CD4+ muy disminuidos, y uno de los factores que predisponen
a exacerbación de las lesiones es el síndrome inflamatorio de reconstitución inmune
(48,49). Cursa con síntomas
inespecíficos dados por tos, disnea y fiebre, y con menor frecuencia hay hallazgo
de lesiones mucocutáneas. En estudios de imágenes se puede observar engrosamiento
de las paredes bronquiales y un patrón nodular con morfología en llama (figura 3).
Durante la fibrobroncoscopia es posible encontrar lesiones endobronquiales maculares
purpúricas o eritematosas, especialmente en las bifurcaciones de la vía aérea. Su
tratamiento incluye el uso de terapia antirretroviral, con buena repuesta en la
mayoría de los casos (48,50).
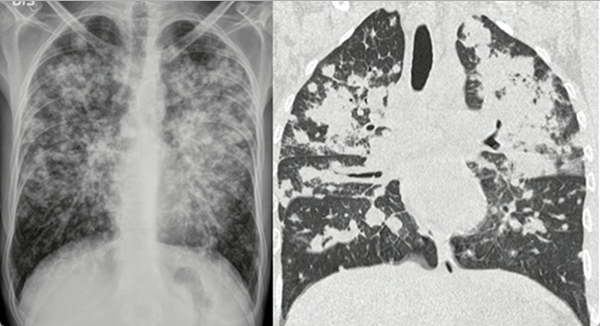 Figura 3
Afectación pulmonar por sarcoma de Kaposi
Figura 3
Afectación pulmonar por sarcoma de Kaposi
El linfoma no Hodgkin es frecuente en estados de inmunosupresión severa. Algunas de sus manifestaciones más frecuentes incluyen el linfoma Burkitt y el linfoma B difuso de célula grande, y se sabe que suele desarrollarse en el contexto de coinfección con el virus Epstein-Barr (48,49,51). Debe sospecharse en pacientes con conteos de CD4+ bajos que consultan por tos, disnea y síntomas B, o ante la presencia de linfadenopatías y hepatoesplenomegalia. En la tomografía computarizada se observan múltiples nódulos periféricos distribuidos hacia las bases, y el diagnóstico definitivo precisa la realización de una biopsia de ganglios linfáticos (48).
Cáncer pulmonar
Constituye la neoplasia no definitoria de sida más frecuente y el subtipo histológico más común es el adenocarcinoma (48,52), seguido del carcinoma escamocelular, el carcinoma de células grandes y el carcinoma de células pequeñas (53,54). El riesgo de padecer esta entidad es dos a siete veces mayor en pacientes con VIH (55,56) y se relaciona estrechamente con las altas tasas de tabaquismo documentadas en estos individuos, en comparación con la población general (48,57). Se considera que la infección retroviral es un factor de riesgo aislado para desarrollar enfermedad neoplásica de forma prematura (49).
Por lo general, el diagnóstico es más temprano y suele identificarse en etapas más avanzadas, por lo que se sospecha un fenotipo más agresivo que en individuos seronegativos. Según resultados publicados por el National Lung Screening Trial Research Team, en 2011 (58), en sujetos con VIH y recuentos de CD4+ superiores a 200 células/mm3 no hay mayor probabilidad de encontrar hallazgos anormales en tomografía axial computarizada de bajas dosis, en comparación con personas no infectadas (59), por lo que la tamización en este grupo poblacional aún constituye un reto.
Enfermedad de Castleman
Es un trastorno linfoproliferativo asociado a la infección por virus herpes humano tipo 8. La prevalencia es desconocida, pero se ha vuelto más frecuente en la era pos-TARV. La mayoría de los pacientes que la padecen tienen un recuento de CD4+ por encima de 200 células/mm3 y típicamente presentan fiebre, pérdida de peso, enfermedad pulmonar intersticial, derrames pleurales y hepatoesplenomegalia (60). Dado que los hallazgos iniciales pueden ser sugestivos de linfoma, es necesario descartar otras entidades antes de hacer el diagnóstico definitivo.
Los principales hallazgos radiológicos son las opacidades intersticiales bilaterales, linfadenopatías mediastinales y derrame pleural. La tomografía computarizada revela con frecuencia opacidades micronodulares y reticulares con distribución linfangítica y patrón en vidrio esmerilado (61). El diagnóstico es histológico por medio de biopsia ganglionar y la patología se caracteriza por hipertrofia de los nodos linfáticos con hiperplasia linfoide angiofolicular (60), por lo que la broncoscopia suele ser innecesaria. También es común encontrar anemia, reacción en cadena de la polimerasa elevada por encima de 200 mg/ml y alteración de pruebas de función hepática. El pronóstico, por lo general, es sombrío debido a las altas tasas de mortalidad.
Linfoma de efusión primario
El linfoma de efusión
primario es una enfermedad linfoproliferativa de células B que corresponde al 3 %
de los casos de linfoma asociados a sida (62). Se asocia a coinfección
con virus herpes humano tipo 8 y ocurre en pacientes con VIH en estadios avanzados,
con conteos de CD4+ promedio de 150 células/mm3 (60). Dos tercios de los
individuos afectados presentan hepatoesplenomegalia y en el 85 % de los casos se
documenta derrame pleural compatible con exudado linfocítico y lactato deshidrogenasa
(LDH) elevada. En la mitad de los casos hay hallazgo de ascitis (63,64) y derrames pericárdicos
malignos, que progresan a taponamiento cardiaco y obligan al paciente a consultar
de inmediato. El hemograma revela anemia y trombocitopenia en el 50 % de los sujetos
y puede haber hipoalbuminemia asociada (63). La tomografía suele
evidenciar derrame pleural como único hallazgo (51). Dado que la prevalencia
es baja, debe considerarse un diagnóstico de exclusión.
Síndrome inflamatorio de reconstitución
inmune
El síndrome inflamatorio de reconstitución inmune se presenta en el 10 % de los pacientes con infección por VIH entre las primeras dos y doce semanas después del inicio del tratamiento (25), como consecuencia adversa a la restauración de la respuesta inmunológica inducida por la TARV, acompañado de alteraciones en la función y redistribución de las subpoblaciones de linfocitos T CD4+ ayudadores y reguladores. Los factores de riesgo descritos para desarrollar esta entidad son la inmunosupresión severa, la respuesta virológica a la TARV, conteo bajo de CD4+ e infección subclínica en el momento del inicio del tratamiento (65). También se asocia con el antecedente de enfermedades oportunistas, la existencia de enfermedades diseminadas y la identificación de títulos elevados de antígenos microbianos en líquidos corporales (66).
Se caracteriza por la exacerbación de infecciones subclínicas preexistentes o la manifestación de enfermedades autoinmunes y neoplásicas (65). No hay pruebas específicas para realizar el diagnóstico definitivo, por lo que el elemento crucial es la sospecha clínica. El éxito del tratamiento radica en la continuación de la TARV y el manejo conjunto de las infecciones oportunistas. Se recomienda el empleo de prednisona en dosis de 0,5 a 1 mg/kg/día durante 5 a 10 días, teniendo en cuenta que la mayoría de los síntomas se resuelven de manera espontánea (25).
Enfermedad pulmonar obstructiva
crónica
La prevalencia de la enfermedad pulmonar obstructiva crónica en los pacientes con infección por VIH varía entre el 6,8 % y el 21 %, dependiendo de las series (6,67). La mortalidad se ha triplicado en esta población con el advenimiento de la TARV (68). Entre las consecuencias de la introducción de dicha terapia también está el incremento de la expectativa de vida con respecto a las décadas precedentes, lo que ha condicionado exposición más prolongada a sustancias nocivas del ambiente. Otros factores de riesgo que predisponen al desarrollo de la enfermedad pulmonar obstructiva crónica incluyen infecciones respiratorias a repetición, uso de drogas intravenosas, colonización por P. jirovecii y el VIH propiamente dicho (69,70).
Clínicamente, se caracteriza por la presencia de tos crónica con expectoración y disnea. El diagnóstico se realiza con una espirometría posbroncodilatador que documente una relación VEF1/CVF < 0,70 (6,71). Los hallazgos en la radiografía de tórax son los mismos que en la población general y están dados por hiperinsuflación pulmonar, aplanamiento de los hemidiafragmas y, en caso de enfermedad enfisematosa avanzada, signos de neumotórax. La tomografía computarizada documenta presencia de vías aéreas terminales prominentes, enfisema y mosaico de atenuación como resultado del atrapamiento de aire (72).
Hipertensión arterial pulmonar
La prevalencia
de hipertensión arterial pulmonar en pacientes con VIH es casi mil veces mayor con
respecto a la población general y se aproxima al 0,5 % (6,73,74). Algunos factores de
riesgo para desarrollarla incluyen el sexo femenino, uso de drogas intravenosas
e infección crónica por el virus de hepatitis C (75). En algunos casos se
ha registrado la presencia de virus herpes humano tipo 8 en las lesiones vasculares
plexiformes típicas de esta condición (76). Debe sospecharse enfermedad
avanzada en pacientes que refieren disnea progresiva, dolor torácico y síncope,
con hallazgo de signos de sobrecarga hídrica en el examen físico. En la radiografía
de tórax es posible observar crecimiento de las cavidades cardiacas y de las arterias
pulmonares; sin embargo, el diagnóstico confirmatorio requiere cateterismo de cavidades
derechas (48,77).
Conclusión
El pulmón es uno de los órganos más afectados por enfermedades tanto infecciosas como no infecciosas en el contexto del paciente inmunocomprometido por VIH, por lo que el conocimiento preciso acerca de la epidemiología y las características de dichas patologías es fundamental en la orientación diagnóstica y terapéutica de estos pacientes.
Las investigaciones futuras deben dirigirse a la descripción sistematizada de la prevalencia de las entidades no infecciosas, cada vez más frecuentes, y a la inclusión de pacientes con VIH en experimentos clínicos aleatorizados, dado que la mayoría de los resultados derivados de dichos estudios no son extrapolables a esta población, con el fin de garantizar mejores aproximaciones terapéuticas, menor incapacidad y, sobre todo, mejor calidad de vida.
Conflictos de interés
Los autores
declaran que no existen conflictos de interés.
Referencias
1. Ministerio de Salud y Protección Social. Guía de práctica clínica (GPC) basada en la evidencia científica para la atención de la infección por VIH/sida en adolescentes (con 13 años de edad o más) y adultos. Bogotá: Ministerio; 2014.
2. Montúfar-Andrade FE, Villa-Franco JP, Montúfar-Pantoja MC, et al. Compromiso pulmonar en pacientes hospitalizados con infección por el virus de inmunodeficiencia humana en el Hospital Pablo Tobón Uribe (Medellín, Colombia). Infectio. 2015;83:1-7.
3. Organización Mundial de la Salud. 10 datos sobre el VIH/sida [internet]. 2016. [Citado 17 de mayo del 2017]. Disponible en: http://www.who.int/features/factfiles/hiv/es/.
4. Organización Mundial de la Salud. VIH/sida: nota descriptiva. 2017 Jul. [Citado 2017 jul]. Disponible en: http://www.who.int/mediacentre/factsheets/fs360/es/.
5. Maximous S, Huang L, Morris A. Evaluation and diagnosis of HIV-associated lung disease. Semin Respir Crit Care Med. 2016;37(2):199-213.
6. Triplette M, Crothers K, Attia EF. Non-infectious pulmonary diseases and HIV. Curr HIV/AIDS Rep. 2016;13(3):140-8.
7. Murcia IM, León CI, De la Hoz F, Saravia J. Asociación micobacterias-VIH/sida en pacientes atendidos en un hospital universitario en Bogotá, Colombia. Rev Salud Pública. 2007;9:97-105.
8. Cañas Arboleda A, Calderón Quintero A. Huérfano Castro M. Hallazgos broncoscópicos de pacientes con infección por VIH y neumonía por Pneumocystis jirovecii pneumonia en el Hospital Universitario San Ignacio. Rev Colomb Neumol. 2012;24:24-7.
9. Acevedo J, González J, Sánchez M, Tobón CM. Incidencia de neumonía por Pneumocystis jirovecii en pacientes con síndrome de inmunodeficiencia adquirida en el Hospital La María de Medellín (Colombia), entre 2008-2009. Infectio. 2012;16:23-30.
10. Martín Rubio A, Omar Mohamed M, Romero Ferreira M, García Jiménez R, Hernández Burruezo J. Neumonía bacteriana comunitaria en el paciente con infección por el VIH. Med Integr. 2001;38:355-62.
11. Madeddu G, Laura Fiori M, Stella Mura M. Bacterial community-acquired pneumonia in HIV-infected patients. Curr Opin Pulm Med. 2010;16(3):201-7.
12. Manno D, Puoti M, Signorini L, et al. Risk factors and clinical characteristics associated with hospitalization for community-acquired bacterial pneumonia in HIV-positive patients according to the presence of liver cirrhosis. Infectio. 2009;37(4):334-9.
13. Malinis M, Myers J, Bordon J, et al. Clinical outcomes of HIV-infected patients hospitalized with bacterial community-acquired pneumonia. Int J Infect Dis. 2010;14(1):e22-7.
14. Benito N, Moreno A, Miro JM, Torres A. Pulmonary infections in HIV-infected patients: An update in the 21st century. Eur Respir J. 2012:730-45.
15. Brown J, Lipman M. Community-acquired pneumonia in HIV-infected individuals. Curr Infect Dis Rep. 2014;16(3):1-9.
16. Mandell LA, Wunderink RG, Anzueto A, et al. Infectious Diseases Society of America/American Thoracic Society Consensus Guidelines on the Management of Community-Acquired Pneumonia in Adults. Clin Infect Dis. 2007;44(Suppl 2):S27-S72.
17. Christensen D, Feldman C, Rossi P, et al. HIV infection does not influence clinical outcomes in hospitalized patients with bacterial community-acquired pneumonia: Results from the CAPO international cohort study. Clin Infect Dis. 2005;41(4):554-6.
18. Rey A, Losada C, Santillan J, et al. Pneumocystis jiroveci infection in patients with and without HIV: A comparison. Rev Chilena Infectol. 2015;32(2):175-80.
19. Kaplan JE, Hanson DL, Jones JL, Dworkin MS. Viral load as an independent risk factor for opportunistic infections in HIV-infected adults and adolescents. AIDS. 2001;15(14):1831-6.
20. Kanne JP, Yandow DR, Meyer CA. Pneumocystis jiroveci pneumonia: High-resolution CT findings in patients with and without HIV infection. AJR Am J Roentgenol. 2012;198(6):W555-61.
21. Carmona EM, Limper AH. Update on the diagnosis and treatment of Pneumocystis pneumonia. Ther Adv Respir Dis. 2011;5(1):41-59.
22. Tasaka S. Pneumocystis pneumonia in human immunodeficiency virus-infected adults and adolescents: Current concepts and future directions. Clin Med Insights Circ Respir Pulm Med. 2015;9(Suppl 1):19-28.
23. Boiselle PM, Crans CAJ, Kaplan MA. The changing face of Pneumocystis carinii pneumonia in AIDS patients. AJR Am J Roentgenol. 1999;172(5):1301-9.
24. Walzer PD, Evans HER, Copas AJ, Edwards SG, Grant AD, Miller RF. Early predictors of mortality from Pneumocystis jirovecii pneumonia in HIV-infected patients: 1985-2006. Clin Infect Dis. 2008;46(4):625-33.
25. Organización Panamericana de la Salud. Coinfección TB/VIH: Guía clínica. Washington, D.C.: OPS; 2010.
26. Getahun H, Gunneberg C, Granich R, Nunn P. HIV infection-associated tuberculosis: The epidemiology and the response. Clin Infect Dis. 2010;50 Suppl 3:1-7.
27. Cortés JA, Hidalgo P, Rey Sánchez DL, Parra Serrano GA, Gutiérrez IF. Tuberculosis en pacientes con infección por VIH en el Hospital Universitario de San Ignacio, 2002-2006. Infectio. 2007;11:16-22.
28. Bruchfeld J, Correia-Neves M, Kallenius G. Tuberculosis and HIV coinfection. Cold Spring Harb Perspect Med. 2015;5(7):1-10.
29. Lomte N, Bandgar T, Khare S, et al. Bilateral adrenal masses: a single-centre experience. Endocr Connect. 2016;5(2):92-100.
30. Huang Y-C, Tang Y-L, Zhang X-M, Zeng N-L, Li R, Chen T-W. Evaluation of primary adrenal insufficiency secondary to tuberculous adrenalitis with computed tomography and magnetic resonance imaging: Current status. World J Radiol. 2015;7(10):336-42.
31. Upadhyay J, Sudhindra P, Abraham G, Trivedi N. Tuberculosis of the adrenal gland: A case report and review of the literature of infections of the adrenal gland. Int J Endocrinol. 2014;2014:876037.
32. Jacobson KR. Tuberculosis. Ann Intern Med. 2017;166(3):ITC17-32.
33. Fernández MJ. Evaluación del rendimiento diagnóstico de la prueba molecular automatizada GenXpert MTB/RIF® para la detección de tuberculosis multirresistente y la presencia de resistencia a la rifampicina. [Comunicación personal].
34. Tadesse M, Aragaw D, Rigouts L, Abebe G. Increased detection of smear-negative pulmonary tuberculosis by GeneXpert MTB/RIF® assay after bleach concentration. Int J Mycobacteriology. 2016;5(2):211-218.
35. Vittor AY, Garland JM, Gilman RH. Molecular diagnosis of TB in the HIV positive population. Ann Glob Heal. 2014;80(6):476-85.
36. Castañer E, Gallardo X, Maria Mata J, Esteba L. Radiologic approach to the diagnosis of infectious pulmonary diseases in patients infected with the human immunodeficiency virus. Eur J Radiol. 2016;51(2):114-29.
37. Pupaibool J, Limper AH. Other HIV-associated pneumonias. Clin Chest Med. 2013;34(2):243-54.
38. Skalski JH, Limper AH. Fungal, viral, and parasitic pneumonias associated with human immunodeficiency virus. Semin Respir Crit Care Med. 2016;37(2):257-66.
39. Park BJ, Wannemuehler KA, Marston BJ, Govender N, Pappas PG, Chiller TM. Estimation of the current global burden of cryptococcal meningitis among persons living with HIV/AIDS. AIDS. 2009;23(4):525-30.
40. Malabonga VM, Basti J, Kamholz SL. Utility of bronchoscopic sampling techniques for cryptococcal disease in AIDS. Chest. 1991;99(2):370-2.
41. McKinsey DS, Spiegel RA, Hutwagner L, et al. Prospective study of histoplasmosis in patients infected with human immunodeficiency virus: incidence, risk factors, and pathophysiology. Clin Infect Dis. 1997;24(6):1195-1203.
42. Baddley JW, Sankara IR, Rodriquez JM, Pappas PG, Many WJJ. Histoplasmosis in HIV-infected patients in a southern regional medical center: poor prognosis in the era of highly active antiretroviral therapy. Diagn Microbiol Infect Dis. 2008;62(2):151-6.
43. Hage CA, Ribes JA, Wengenack NL, et al. A multicenter evaluation of tests for diagnosis of histoplasmosis. Clin Infect Dis. 2011;53(5):448-54.
44. Denis B, Lortholary O. Infections fongiques pulmonaires chez les patients séropositifs pour le VIH. Rev Mal Respir. 2013;30(8):682-95.
45. Bhansali A, Das S, Dutta P, et al. Adrenal histoplasmosis: unusual presentations. J Assoc Physicians India. 2012;60:54-8.
46. Roubsanthisuk W, Sriussadaporn S, Vawesorn N, et al. Primary adrenal insufficiency caused by disseminated histoplasmosis: report of two cases. Endocr Pract. 2002;8(3):237-41.
47. Cannon MJ, Schmid DS, Hyde TB. Review of cytomegalovirus seroprevalence and demographic characteristics associated with infection. Rev Med Virol. 2010;20(4):202-13.
48. Staitieh B, Guidot DM. Noninfectious pulmonary complications of human immunodeficiency virus infection. Am J Med Sci. 2014;348(6):502-11.
49. Sigel K, Pitts R, Crothers K. Lung Malignancies in HIV Infection. Semin Respir Crit Care Med. 2016;37(2):267-76.
50. Hamm PG, Judson MA, Aranda CP. Diagnosis of pulmonary Kaposi’s sarcoma with fiberoptic bronchoscopy and endobronchial biopsy. A report of five cases. Cancer. 1987;59(4):807-10.
51. Chou S-HS, Prabhu SJ, Crothers K, Stern EJ, Godwin JD, Pipavath SN. Thoracic diseases associated with HIV infection in the era of antiretroviral therapy: clinical and imaging findings. Radiographics. 2014;34(4):895-911.
52. Brock M V, Hooker CM, Engels EA, et al. Delayed diagnosis and elevated mortality in an urban population with HIV and lung cancer: implications for patient care. J Acquir Immune Defic Syndr. 2006;43(1):47-55.
53. Hessol NA, Martinez-Maza O, Levine AM, et al. Lung cancer incidence and survival among HIV-infected and uninfected women and men. AIDS. 2015;29(10):1183-93.
54. Chaturvedi AK, Pfeiffer RM, Chang L, Goedert JJ, Biggar RJ, Engels EA. Elevated risk of lung cancer among people with AIDS. AIDS. 2007;21(2):207-13.
55. Deeken JF, Tjen-A-Looi A, Rudek MA, et al. The rising challenge of non-AIDS-defining cancers in HIV-infected patients. Clin Infect Dis. 2012;55(9):1228-35.
56. Frisch M, Biggar RJ, Engels EA, Goedert JJ. Association of cancer with AIDS-related immunosuppression in adults. JAMA. 2001;285(13):1736-45.
57. Molto J, Moran T, Sirera G, Clotet B. Lung cancer in HIV-infected patients in the combination antiretroviral treatment era. Transl lung cancer Res. 2015;4(6):678-88.
58. Aberle DR, Adams AM, Berg CD, et al. Reduced lung-cancer mortality with low-dose computed tomographic screening. N Engl J Med. 2011;365(5):395-409.
59. Sigel K, Wisnivesky J, Shahrir S, et al. Findings in asymptomatic HIV-infected patients undergoing chest computed tomography testing: implications for lung cancer screening. AIDS. 2014;28(7):1007-14.
60. Borie R, Cadranel J, Guihot A, Marcelin AG, Galicier L, Couderc L-J. Pulmonary manifestations of human herpesvirus-8 during HIV infection. Eur Respir J. 2013;42(4):1105-18.
61. Guihot A, Couderc L-J, Rivaud E, et al. Thoracic radiographic and CT findings of multicentric Castleman disease in HIV-infected patients. J Thorac Imaging. 2007;22(2):207-11.
62. Carbone A, Gaidano G. HHV-8-positive body-cavity-based lymphoma: A novel lymphoma entity. Br J Haematol. 1997;97(3):515-22.
63. Boulanger E, Gerard L, Gabarre J, et al. Prognostic factors and outcome of human herpesvirus 8-associated primary effusion lymphoma in patients with AIDS. J Clin Oncol. 2005;23(19):4372-80.
64. Boulanger E, Agbalika F, Maarek O, et al. A clinical, molecular and cytogenetic study of 12 cases of human herpesvirus 8 associated primary effusion lymphoma in HIV-infected patients. Hematol J. 2001;2(3):172-9.
65. Calligaro G, Meintjes G, Mendelson M. Pulmonary manifestations of the immune reconstitution inflammatory syndrome. Curr Opin Pulm Med. 2011;17(3):180-8.
66. Reyes-Corcho A, Bouza-Jimenez Y. Human immunodeficiency virus and AIDS-associated immune reconstitution syndrome. State of the art. Enferm Infecc Microbiol Clin. 2010;28(2):110-21.
67. George MP, Kannass M, Huang L, Sciurba FC, Morris A. Respiratory symptoms and airway obstruction in HIV-infected subjects in the HAART era. PLoS One. 2009;4(7):1-14.
68. Gelman M, King MA, Neal DE, Pacht ER, Clanton TL, Diaz PT. Focal air trapping in patients with HIV infection: CT evaluation and correlation with pulmonary function test results. AJR Am J Roentgenol. 1999;172(4):1033-8.
69. Gingo MR, George MP, Kessinger CJ, et al. Pulmonary function abnormalities in HIV-infected patients during the current antiretroviral therapy era. Am J Respir Crit Care Med. 2010;182(6):790-6.
70. Morris A, George MP, Crothers K, et al. HIV and chronic obstructive pulmonary disease: is it worse and why? Proc Am Thorac Soc. 2011;8(3):320-5.
71. Global Strategy for the Diagnosis, Management and Prevention of COPD, Global Initiative for Chronic Obstructive Lung Disease (GOLD) 2017 [Internet]. Disponible en: http://goldcopd.org.
72. Scourfield AT, Doffman SR, Miller RF. Chronic obstructive pulmonary disease in patients with HIV: An emerging problem. Br J Hosp Med (Lond). 2014;75(12):678-84.
73. Speich R, Jenni R, Opravil M, Pfab M, Russi EW. Primary pulmonary hypertension in HIV infection. Chest. 1991;100(5):1268-71.
74. Sitbon O, Lascoux-Combe C, Delfraissy J-F, et al. Prevalence of HIV-related pulmonary arterial hypertension in the current antiretroviral therapy era. Am J Respir Crit Care Med. 2008;177(1):108-13.
75. Correale M, Palmiotti GA, Lo Storto MM, et al. HIV-associated pulmonary arterial hypertension: from bedside to the future. Eur J Clin Invest. 2015;45(5):515-28.
76. Cool CD, Rai PR, Yeager ME, et al. Expression of human herpesvirus 8 in primary pulmonary hypertension. N Engl J Med. 2003;349(12):1113-22.
77. Lichtenberger JP 3rd, Sharma A, Zachary KC, et al. What a differential a virus makes: a practical approach to thoracic imaging findings in the context of HIV infection--part 2, extrapulmonary findings, chronic lung disease, and immune reconstitution syndrome. AJR Am J Roentgenol. 2012;198(6):1305-12.
Notas
*
Artículo de Revisión
Notas de autor
a
Autor de
correspondencia. Correo electrónico: alejandra.canas@javeriana.edu.co
Información adicional
Cómo citar: González Villarreal L, Hincapié Echeverría M, Tassinari
S, Cañas Arboleda A, Celis Preciado C. Compromiso pulmonar en pacientes con infección por el
Virus de Inmunodeficiencia Humana (VIH). Univ Med. 2018;59(1):xx-xx. https://doi.org/10.11144/Javeriana.umed59-1.cppi